
|
Первый работоспособный свинцово-кислотный аккумулятор был изобретен в 1859 г. французским ученым Гастоном Планте. Конструкция аккумулятора представляла собой электроды из листового свинца, разделенные сепараторами из полотна, которые были свернуты в спираль и помещены в сосуд с 10 % раствором серной кислоты. Недостатком первых свинцово-кислотных аккумуляторов была их невысокая емкость. Поначалу для ее увеличения проводили большое число циклов заряда-разряда. Для достижения существенных результатов требовалось до двух лет таких тренировок. Причина недостатка была явной - конструкция пластин. Поэтому дальнейшее совершенствование конструкции свинцово-кислотных аккумуляторов было сосредоточено на совершенствование конструкции используемых в них пластин и сепараторов. В 1880 г. К. Фор предложил методику изготовления намазных электродов путем нанесения на пластины окислов свинца. Такая конструкция электродов позволила значительно повысить емкость аккумуляторов. А в 1881 г. Э. Фолькмар предложил применять в качестве электродов намазную решетку. В том же году ученому Селлону был выдан патент на технологию изготовления решеток из сплава свинца и сурьмы. Первоначально практическое использование свинцово-кислотных аккумуляторов было затруднено из-за отсутствия зарядных устройств - для заряда применяли первичные элементы конструкции Бунзена. То есть химический источник тока заряжался от другого химического источника - батареи гальванических элементов. Положение кардинально поменялось с появлением недорогих генераторов постоянного тока. Именно свинцово-кислотные батареи первыми в мире из аккумуляторных батарей нашли коммерческое применение. К 1890 году во многих промышленно развитых странах был освоен их серийный выпуск. В 1900 году немецкая фирма Varta произвела первые стартерные аккумуляторы для автомобилей. В 70-х годах XX века были созданы необслуживаемые свинцово-кислотные аккумуляторные батареи, способные работать в любом положении. Жидкий электролит в них сменили гелиевым или адсорбированным (впитанным) сепараторами электролитом, батареи герметизировали, а для отвода газов, выделяющихся при заряде или разряде, установили клапаны. Строго говоря, абсолютная герметизация свинцово-кислотных аккумуляторов не может быть достигнута, так как нельзя обеспечить полную рекомбинацию кислорода и водорода, которые выделяются в них при заряде и хранении. Но специальными мерами выделение газов и потери воды в процессе эксплуатации удается свести к минимуму. Были разработаны новые конструкции пластин на базе медно-кальциевых сплавов, покрытых оксидом свинца, а также на основе титановых, алюминиевых и медных решеток. Свинцовые аккумуляторы являются наиболее распространенными среди всех существующих в настоящее время химических источников тока. Их масштабное производство определяется как относительной дешевизной используемых материалов и высокой степени автоматизации производства, так и разработкой разных вариантов этих аккумуляторов, отвечающих требованиям широкого круга потребителей. Наилучшие образцы первых аккумуляторов, конца 19в., имели удельную энергию по массе 7-8 Вт•ч/кг при продолжительном разряде (у нынешних образцов 40-47 Вт•ч/кг). Сейчас выпускаются герметизированный автомобильные аккумуляторы с иммобилизованным (гелеобразным или абсорбированным) электролитом, эти аккумуляторы обеспечивают работоспособность в любом пространственном положении и применяются в системах резервного и аварийного энергоснабжения, бытовой технике и т.п. Активными веществами свинцового аккумулятора, принимающими участие в токообразующих реакциях, являются: В ходе разряда аккумулятора активная масса отрицательного электрода превращается из губчатого свинца в сульфат свинца, со сменой серого цвета на светло-серый, отдавая два электрона в электрическую цепь. Pb + HSO4- → PbSO4 + H+ + 2e- Активная масса положительного электрода по ходу разряда превращается из двуокиси свинца PbO2, так же как и активная масса отрицательного электрода, в сульфат свинца PbSO4 с изменением цвета с темно-коричневого на светло-коричневый, поглощая два електрона.
PbO2 + HSO4- + 3H+ + 2e- → PbSO4 + 2H2O В результате разряда аккумулятора активные материалы и положительного (PbO2), и отрицательного (Pb) электродов преобразуются в сульфат свинца PbSO4. При этом на формирование сульфата свинца расходуется серная кислота, что вызывает снижение концентрации электролита и как следствие снижение его плотности. Суммарная реакция при разряде аккумулятора:
PbO2 + Pb + 2H2SO4 → 2PbSO4 + 2H2O При зарядке аккумулятора идут обратные в противоположную сторону, в ходе которых кроме всего прочего происходит образование серной кислоты, в результате чего при заряде растет плотность электролита. Суммарное уравнение процесса заряда:
2PbSO4 + 2H2O → PbO2 + Pb + 2H2SO4 Когда реакции преобразования веществ в активных массах положительного и отрицательного электродов завершены, плотность электролита перестает меняться, что служит признаком завершения заряда аккумулятора. При дальнейшем продолжении заряда протекает так называемый вторичный процесс - электролитическое разложение воды на кислород и водород. Выделяясь из электролита в виде пузырьков газа, они создают иллюзию кипения электролита, что тоже служит признаком завершения процесса заряда. Каждый аккумулятор состоит из пространственно разделенных разноименных электродов, погруженных в раствор электролита и помещенных в прочный корпус, который устойчив к химическому воздействию электролита, механическим нагрузкам и температурным колебаниям. Активная масса электродов обладает высокой пористость (47-60%) и у заряженных аккумуляторов на положительном электроде состоит в основном из двуокиси свинца PbO2 (85-90 %), а на отрицательном электроде - из губчатого свинца Pb (80-90 %). Раньше для изготовления корпуса аккумуляторов использовали эбонит, который обладает относительно низкой механической прочностью. Поэтому стенки эбонитовых блоков имеют толщину 6-8 мм для аккумуляторных батарей до 90 А•ч и 9-12 мм при емкости более 100 А•ч. При переходе с эбонита на сополимер полипропилена с этиленом, удается уменьшить толщину стенок в два раза и понизить массу корпусных деталей без ухудшения их надежности. Необслуживаемые автомобильные аккумуляторы За последние десятилетия произошло стремительное развитие технологии и совершенствование оборудования для аккумуляторного производства. В итоге на рынке появилось несколько видов, так называемых, необслуживаемых автомобильных аккумуляторов. Особенностью таких аккумуляторов является использование для производства токоотводов, сплавов без сурьмы или с ее пониженным содержанием. Необслуживаемые аккумуляторы начали изготавливать в США в конце семидесятых годов прошлого столетия. Для токоотводов и положительного, и отрицательного электродов применялся свинцово-кальциевый сплав с содержанием кальция 0,07-0,1% и олова 0,1-0,12% (остальное - свинец). Это позволило достигнуть значительного снижения газовыделения, которое обеспечивало эксплуатацию аккумуляторов без доливки воды в течение 2 лет и более. При этом саморазряд замедлился более чем в шесть раз. Но после двух-трех глубоких разрядов такие аккумуляторы теряют 40-50% емкости и их стартерные характеристики также значительно снижаются. Поэтому такие аккумуляторы не нашли широкого распространения в Европе и России. Почти одновременно со свинцово-кальциевой технологией производства аккумуляторных батарей необслуживаемого исполнения, в США появилась технология гибридных аккумуляторов - система "кальций плюс" с содержанием до 1,5-1,8% сурьмы и 1,4-1,6% кадмия в положительном токоотводе и отрицательным свинцово-кальциевым токоотводом. В начале восьмидесятых годов производство необслуживаемых аккумуляторов стало стремительно развиваться и в странах Европы. Здесь пошли по пути использования сплавов с пониженным до 2,5-3,0% содержанием сурьмы. У таких аккумуляторов расход воды и саморазряд были в 2-3 раза выше, чем у батарей с кальциевыми токоотводами, хотя и значительно ниже, чем у батарей традиционного исполнения. Они могли работать без доливки воды не менее 1 года. Далее в Европе появляются гибридные аккумуляторные батареи, у которых положительные токоотводы изготовлены из малосурьмяного сплава (не более 2%) с добавлением мышьяка, олова, меди, селена и т.п. в различных сочетаниях и соотношениях; а отрицательные - из свинцово-кальциевого сплава. Их характеристики по расходу воды и саморазряду, как и у американских гибридных аккумуляторов, не такие хорошие, как у свинцово-кальциевых, но все же существенно лучше, чем у батарей по технологии малосурьмяных сплавов. В конце 90-х годов в США и Западной Европе начинается производство аккумуляторов с токоотводами из свинцово-кальциевого сплава с многокомпонентными добавками, в том числе и серебра, которые при глубоких разрядах теряют емкость гораздо медленнее, чем первое поколение аккумуляторных батарей по свинцово-кальциевой технологии. Расход воды у них так мал, что конструкторы убирают с крышек отверстия для доливки воды и делают аккумуляторные батареи полностью необслуживаемыми и исключающими доступ к электролиту при использовании аккумулятора. Такое изменение конструкции стало возможным благодаря общим усилиям производителей аккумуляторов и автомобильного электрооборудования. Ведь для максимального использования ресурса полностью необслуживаемой аккумуляторной батареи (без отверстий для доливки воды) необходимо обеспечить стабильное зарядное напряжение, обеспечивающие минимальное разложение воды при заряде аккумуляторов. В то же время, степень заряженности аккумуляторной батареи должна быть достаточной для безотказной работы всего электрооборудования. Это стало возможно благодаря созданию системы регулирования зарядного напряжения, обеспечивающей его стабильность с точностью ± 0,1 В. Но владельцы автомобилей, решившие использовать необслуживаемые аккумуляторы без отверстий для доливки воды, должны более внимательно относиться к обеспечению исправной работы электрооборудования. Прежде всего это касается натяжения ремня привода генератора, исправности самого генератора, регулятора напряжения, отсутствия утечек тока в системе электрооборудования или сигнализации и ряда других факторов. Автомобильные аккумуляторы, у которых отсутствуют отверстия для доливки воды и имеется только атмосферная связь внутренней полости с окружающей средой через небольшие вентиляционные отверстия на торцах крышки, как правило оснащены индикатором состояния заряженности (рисунок 1): шарик-поплавок зеленого цвета расположен над пластинами, который всплывает, когда электролит при заряде достигает определенной плотности. Эта величина соответствует минимальной степени заряженности (62-64% от номинального значения), при которой индикатор начинает давать информацию о работоспособности аккумуляторной батареи в пусковом режиме. Последующее увеличение плотности электролита (до 100 % заряда) не меняет показания индикатора, что является недостатком данного приспособления. В случаях понижения уровня электролита до оголения пластин, информация индикатора о состоянии заряженности батареи прекращается. При работающем индикаторе его информация относится только к одной из шести банок (ячеек) аккумуляторной батареи. В тех случаях, когда появляется дефект в другой банке, где нет индикатора, информация индикатора становится бесполезной, не отражающей общее состояние (работоспособность) аккумуляторной батареи. Использование индикатора дает полезную информацию о состоянии батареи в тех случаях, когда она не содержит дефекта производственного характера. 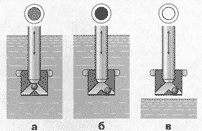 Рис.1 Индикатор заряженности аккумулятора Герметизированные автомобильные аккумуляторы с иммобилизованным электролитом Искусственное ограничение емкости положительных электродов и объема электролита ведут к тому, что емкость герметизированных свинцовых аккумуляторов с иммобилизованным электролитом на 15-20% меньше, чем батарей со свободным электролитом таково же объема и массы. В качестве загустителя для создания гелеобразного электролита применяют силикагель, аллюмогель и другие вещества. При смачивании серной кислотой эти вещества образуют тиксотропный гель. В качестве сепараторов в подавляющем большинстве герметизированных аккумуляторов используют стекломаты из ультратонких волокон. Объемная пористость современных стеклосепараторов достигает 80-85%. Благодаря этому их применяют не только для батарей с гелеобразным электролитом, но и для аккумуляторов с адсорбированным жидким электролитом. В последнем случае технология производства немного дешевле, но емкостные показатели хуже, чем у автомобильных аккумуляторов с гелеобразным электролитом. Это обусловлено еще большим снижением количества электролита в аккумуляторе. Свинцовые аккумуляторные батареи с иммобилизованным электролитом являются герметизированными, но не являются герметичными как, например, никель-кадмиевые герметичные аккумуляторы. Во всех свинцовых герметизированных аккумуляторах есть предохранительный клапан. Он служит для того, чтобы давление внутри аккумулятора не превышало величины, которая является допустимой по условиям работоспособности и прочности корпусных деталей аккумулятора. Дело в том, что, несмотря на используемые ограничения емкости положительных электродов, выделение водорода на отрицательном электроде в процессе заряда, особенно на завершающей стадии, полностью подавить невозможно. Причем скорость его выделения в конце заряда несколько выше, чем скорость выделения кислорода. Избыточная часть водорода вызывает увеличение давления внутри аккумулятора, для ограничения которого и служит клапан. Нормальная эксплуатация герметизированных свинцовых автомобильных аккумуляторов возможна при соблюдении гораздо более жесткого диапазона регулирования зарядного напряжения, чем при эксплуатации необслуживаемых аккумуляторов с жидким электролитом (даже не имеющих отверстий для доливки воды). Максимальная величина зарядного напряжения для автомобильных аккумуляторных батарей с загущенным (гелеобразным) и адсорбированным электролитом зависит от рекомендаций производителя (ориентировочно для гелеобразных 14,35В, а для адсорбированных 14,4В). В случае превышения величины рекомендованной производителем на 0,05В скорость газовыделения становится так велика, что ведет к нарушению контакта активной массы электродов с электролитом, а также к высыханию аккумулятора, в результате чего батарея утрачивает работоспособность. Весьма жесткие ограничения величины зарядного напряжения, наряду с гораздо более высокой стоимостью герметизированных автомобильных аккумуляторных батарей в сравнении с необслуживаемыми, создают определенные трудности для их широкого использования на автомобилях.
Cp=Ip•Tp Разрядная емкость, на которую рассчитан аккумулятор и которая указывается изготовителем, называется номинальной емкостью. Кроме нее, важным показателем является также емкость, сообщаемая аккумуляторной батарее при заряде, которая вычисляется по формуле (при Iз = const):
Cз = Iз • Tз Разрядная емкость аккумулятора зависит от целого ряда конструктивных и технологических параметров, а также от условий эксплуатации аккумулятора. Наиболее значимыми конструктивными параметрами являются количество активной массы и электролита, толщина и геометрические размеры аккумуляторных электродов. Главными технологическими параметрами, влияющими на емкость аккумулятора, являются рецептура активных материалов и их пористость. Эксплуатационные параметры - температура электролита и сила разрядного тока - также оказывают существенное влияние на разрядную емкость. Обобщенным показателем, характеризующим эффективность работы аккумулятора, является коэффициент использования активных материалов Θ,%: Θ = (Cp / Co) • 100% где Cp - емкость аккумулятора, полученная при его разряде, А•ч; Co - теоретическая емкость того же аккумулятора, рассчитанная по электрохимическим эквивалентам, А•ч. Для получения емкости в 1 А•ч, по закону Фарадея, теоретически необходимо 4,462г двуокиси свинца PbO2, 3,865г губчатого свинца Pb и 3,659г серной кислоты H2SO4. Теоретический удельный расход активных масс электродов и серной кислоты, после суммирования получается 11,986 г/А•ч. Однако на практике нереально достигнуть полного использования активных материалов, принимающих участие в токообразующем процессе. Примерно половина поверхности активной массы недоступна для электролита, так как является основой для создания объемного пористого каркаса, обеспечивающего механическую прочность материала. Вследствие этого реальный коэффициент использования активных масс положительного электрода составляет 45-55%, а отрицательного 50-65%. Кроме этого, в качестве электролита используется 35-38%-ый раствор серной кислоты. Таким образом величина реального удельного расхода материалов существенно выше, а реальные значения удельной емкости и удельной энергии существенно ниже, чем теоретические. На уровень использования активной массы, а следовательно, и на величину разрядной емкости оказывают влияние следующие основные факторы. Пористость активной массы. С повышением пористости улучшаются условия диффузии электролита в глубину активной массы электрода и возрастает истинная поверхность, на которой протекает токообразующая реакция. С увеличением пористости повышается разрядная емкость. Величина пористости зависит от размеров частиц свинцового порошка и рецептуры приготовления активных масс, а также от используемых добавок. Причем повышение пористости ведет к уменьшению долговечности вследствие ускорения процесса деструкции высокопористых активных масс. Поэтому уровень пористости выбирается производителями с учетом не только высоких емкостных характеристик, но и обеспечения требуемой долговечности батареи в эксплуатации. Сейчас оптимальной считается пористость в пределах 46-60%, в зависимости от предназначения аккумулятора. Толщина электродов. С понижением толщины снижается неравномерность нагруженности внешних и внутренних слоев активной массы электрода, что способствует повышению разрядной емкости. У более толстых электродов внутренние слои активной массы используются очень незначительно, в особенности при разряде большими токами. Пористость материала сепаратора. С возрастанием пористости сепаратора и высоты его ребер повышается запас электролита в межэлектродном зазоре и улучшаются условия его диффузии. Концентрация электролита. При повышении концентрации серной кислоты емкость положительных электродов повышается, а емкость отрицательных, особенно при отрицательной температуре, снижается вследствие ускорения пассивации поверхности электрода. Повышенная концентрация также отрицательно сказывается на сроке службы аккумулятора вследствие ускорения коррозионных реакций на положительном электроде. Поэтому оптимальная концентрация электролита устанавливается исходя из совокупности требований и условий, в которых эксплуатируются аккумуляторы. Так, например, для стартерных аккумуляторов, работающих в умеренном климате, рекомендована рабочая концентрация при которой плотность электролита равна 1,26-1,28 г/см3, а для районов с жарким (тропическим) климатом плотность электролита должна быть 1,22-1,24 г/см3. Сила разрядного тока. Режимы разряда условно разделяют на длительные и короткие. При длительных режимах, разряд совершается малыми токами в ходе нескольких часов. Например, 5-, 10- и 20-часовой разряды. При коротких или стартерных разрядах сила тока в несколько раз больше номинальной емкости аккумулятора, а разряд продолжается несколько минут или секунд. При повышении разрядного тока скорость разряда поверхностных слоев активной массы возрастает в большей степени, чем глубинных. В результате рост сернокислого свинца в устьях пор происходит быстрее, чем в глубине, и пора закупоривается сульфатом раньше, чем успевает прореагировать ее внутренняя поверхность. Вследствие прекращения диффузии электролита внутрь поры реакция в ней прекращается. Следственно, чем больше разрядный ток, тем ниже емкость аккумулятора, а следовательно, и коэффициент использования активной массы. Так, например, при разряде батареи емкостью 55 А•ч током 2,75 А при температуре электролита +25 °С ее емкость составляет C20=55÷60А•ч, а при разряде током 255А (4,6C20) емкость уменьшается более чем в 2 раза и составляет всего 22А•ч. Для оценки пусковых качеств автомобильных аккумуляторов, их емкость характеризуется также количеством прерывистых стартерных разрядов (например, длительностью 10-15с с паузами между ними по 60с). Емкость, которую отдает батарея при прерывистых разрядах, превосходит емкость при непрерывном разряде тем же током, в особенности при стартерном режиме разряда (Ip = 2÷5 C20). В настоящее время в международной практике оценки емкостных характеристик стартерных аккумуляторов используется понятие "резервная" емкость. Она характеризует время разряда батареи (в минутах) при силе разрядного тока 25А независимо от номинальной емкости аккумуляторной батареи. По усмотрению изготовителя допускается устанавливать величину номинальной емкости при 20-часовом режиме разряда в ампер-часах или по резервной емкости в минутах. Температура электролита. С понижением температуры разрядная емкость аккумуляторов понижается. Причина этого - повышение вязкости электролита и его электрического сопротивления, что замедляет скорость диффузии электролита в поры активной массы. Зависимость времени разряда Тр автомобильных аккумуляторов от силы разрядного тока Iр при различных температурах от +25 °С до -30 °С приведена на рисунке 2 (для различных аккумуляторов значения могут отличаться).
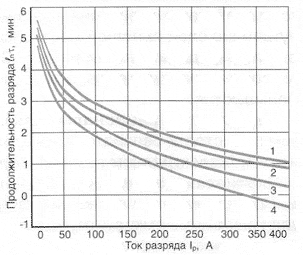 Рис.2 Зависимость продолжительности разряда необслуживаемой аккумуляторной батареи от силы тока при различных температурах: 1 - (+25°C), 2 - (0°C), 3 - (-18°С), 4 - (-30°С) Саморазряд автомобильного аккумулятора Pb + H2SO4 → PbSO4 + H2↑. Саморазряд отрицательного электрода сопровождается выделением газообразного водорода. Скорость самопроизвольного растворения свинца существенно повышается с увеличением концентрации серной кислоты. Повышение плотности электролита с 1,27 до 1,32 г/см3 ведет к росту скорости саморазряда отрицательного электрода на 40%. Присутствие примесей разных металлов на поверхности отрицательного электрода оказывает весьма существенное влияние (каталитическое) на рост скорости саморастворения свинца (вследствие понижения перенапряжения выделения водорода). Практически все металлы, встречающиеся в виде примесей в аккумуляторном сырье, электролите и сепараторах, способствуют увеличению саморазряда. Попадая на поверхность отрицательного электрода, они облегчают условия выделения водорода. Часть примесей (соли металлов с переменной валентностью) действуют как переносчики зарядов с одного электрода на другой. В таком случае ионы металлов восстанавливаются на отрицательном электроде и окисляются на положительном (такой механизм саморазряда приписывают ионам железа). Саморазряд положительного активного материала обусловлен протеканием реакции: 2PbO2 + 2H2SO4 → PbSO4 + 2H2O + O2↑. Скорость данной реакции также увеличивается с ростом концентрации электролита. Скорость саморазряда положительного активного материала в несколько раз ниже скорости саморазряда отрицательного активного материала. Еще одной причиной саморазряда положительного электрода является разность потенциалов материала токоотвода и активной массы этого электрода. Возникающий вследствие этой разности потенциалов гальванический микроэлемент превращает, при протекании тока, свинец токоотвода и двуокись свинца положительной активной массы в сульфат свинца. Саморазряд может возникать также, когда аккумулятор снаружи загрязнен или залит электролитом, водой или другими жидкостями, которые создают возможность разряда через электропроводную пленку, находящуюся между полюсными выводами аккумулятора или его перемычками. Этот тип саморазряда не отличается от обычного разряда очень малыми токами при замкнутой внешней цепи и легко устраняется. Для этого необходимо содержать поверхность автомобильного аккумулятора в чистоте. Саморазряд аккумуляторов в значительной мере зависит от температуры электролита. Эта зависимость показана на рисунке 3, где видно, что с уменьшением температуры саморазряд понижается. При температуре ниже 0°С у новых аккумуляторных батарей он практически прекращается. Поэтому хранить автомобильные аккумуляторы рекомендуется в заряженном состоянии при низких температурах (до -30 °С). Из рисунка также видно, что в течении эксплуатации саморазряд не остается постоянным и резко усиливается к концу срока службы. 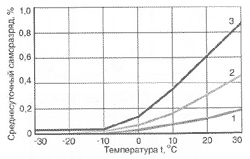 Рис.3 Среднесуточный саморазряд необслуживаемой аккумуляторной батареи за три месяца в зависимости от температуры и продолжительности эксплуатации (содержание Sb - 2,5%): 1 - новый аккумулятор, 2 - аккумулятор после среднего срока эксплуатации, 3 - аккумулятор в конце срока службы Понижение саморазряда возможно за счет использования наиболее чистых материалов для производства аккумуляторов; за счет уменьшения количественного содержание легирующих элементов в аккумуляторных сплавах; за счет использования только чистой серной кислоты и дистиллированной воды (или близкой к ней по чистоте при других методах очистки) для получения всех электролитов, как при производстве, так и при эксплуатации. Например, благодаря понижению содержания сурьмы в сплаве токоотводов с 5% до 2% и использованию дистиллированной воды для всех технологических электролитов, среднесуточный саморазряд уменьшается в 4 раза. Замена сурьмы на кальций позволяет еще больше уменьшить скорость саморазряда (рисунок 4). Снижению скорости саморазряда могут также способствовать добавки органических ингибиторов саморазряда. 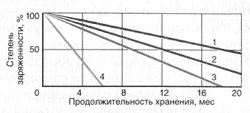 Рис.4 Изменение уровня заряженности автомобильных аккумуляторов различных конструкций при хранении: 1 - аккумуляторы со свинцово-кальциевыми сплавами, 2 - гибридные аккумуляторы, 3 - аккумуляторы с малосурьмяными сплавами, 4 - аккумуляторы традиционного исполнения |
Комментарии (0) | |
